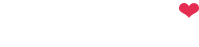Кістковомозкове кровотворення
Центральними органами гемопоезу є кістковий мозок та підгрудинна залоза (тимус). Кістковий мозок містить пул стовбурових клітин, котрий безперервно поповнюється та є джерелом продукування всіх гемопоетичних клітин; у ньому відбуваються проліферація і дозрівання елементів мієлопоезу та початкові стадії диференціїовання B-лімфоцитів. У підгруданній залозі дозрівають Т-лімфоцити. До периферичних органів гемопоезу належать селезінка, де дозрівають різні клітини крові, в тому числі й ретикуло-цити та B-лімфоцити, а також лімфатичні вузли, мукоз — асоційована лімфоїдна тканина (MALT), периферична кров, котра вміщує стовбурові клітини та імунологічно компетентний пул В- і Т-лімфоцитів.
Кістковий мозок розташований на балках плоских та трубчастих кісток. До складу кісткового мозку входять власне гемопоетич-ні елементи всіх рівнів диференціювання та стромальні клітини. Кровотворні клітини розташовані острівцями на підстилці із клітин ендосту та епітеліальних клітин, обплутані та пронизані стро-мальними елементами, такими як ендотеліальні та адвентиціальні клітини, адипоцити, фібробласти й остеобласти (так звані елементи мікрооточення). Разом зі стромальними елементами активно співпрацюють гемопоетичні клітини моноцитарно-макрофагаль-ного ряду.
У функціонуванні системи мікрооточення важливу роль відіграє позаклітинний матрикс, котрий є продуктом життєдіяльності та розпаду клітин і складається із ламиніну, фібронектину, гемо-нектину, колагену, тромбосподину, глікозоаміногліканів. Матрикс сприяє прикріпленню гемопоетичних клітин до елементів кістко-вомозкового бар'єру та утримує їх до моменту остаточного дозрівання. Різні складові частини матриксу взаємодіють із клітинами різних ліній. Приміром, фібронектин зв'язується з елементами гра-нулоцитарного ряду, а гемонектин — з еритроїдними клітинами.
Система мікрооточення забезпечує підтримання клітин кісткового мозку, зберігаючи його структуру в кровотоку, індукує проліферацію та диференціїовання стовбурових клітин, передає інформацію про потребу організму на периферії, продукує різноманітні ростові фактори.
Система гемопоезу — це комплекс клітин, що забезпечує різноманітні функції і в той же час постійно регенерує. Згідно із сучасною схемою кровотворення, існують попередники, котрі продукують різні типи клітинних форм. Ця схема пояснює взаємовідносини гемопоетичних клітин у нормі та при патологічних станах, у тому числі й при гемобластозах. Крім того, відомо, що частина ранніх попередників гемопоезу лишаються розсіяними в ретикулоендотелі-альній системі різних органів і зберігають здатність до проліферації та утворення екстрамедулярних вогнищ кровотворення протягом усього життя людини.
Дослідженнями останніх років встановлено, що справжніми родопочатковими клітинами гемопоезу є стовбурові клітини, котрі закладаються в жовточному мішку ще в період формування плоду. Кількість полілотентних стовбурових клітин (ПСК) не велика і в людини становить приблизно 40 000. З допомогою моноклональ-них антитіл встановлено, що першим на поверхні ПСК з'являється антиген стовбурових клітин (С034), потім послідовно — антиген гістосумісності II класу (НІА-ОЯ), а також фермент термінальна дезоксинуклеотидінтрансфераза (ТаТ). ПСК не мають ознак лінійного диференціювання.
Проліферацію стовбурових клітин індукує система мікроото-чення, а також низка ростових факторів, що продукуються стро-мальними елементами, циклони, рестриктини, адизини.
Пул поліпотентних попередників становить дуже малу (0,01%) фракцію всіх ядровмісних елементів кісткового мозку, проте його проліферативної активності вистачає, щоб забезпечити клітинними елементами кровотворну систему. У кістковому мозку людини щодня продукується 2 • 10й клітин, що становить 300 г. Цю потребу забезпечує 5% ПСК, що перебувають у мітотичному циклі, в той же час усі інші ПСК перебувають у стані спокою — Оо-фазі. ПСК забезпечують постійність вихідного пула та вихід із нього частини клітин у дозріваючу фракцію.
Подальший розвиток мієлоїдного та лімфоїдного паростків кровотворення відбувається із окремого для кожної лінії мієло- або лімфопопередника. Клітини мієлоїдного паростка проліферують та диференціюють у кістковому мозку до зрілих форм (рис. 1).
Загальним попередником мієлопоезу є поліпотентна колоніє-утворююча одиниця гранулоцитів, еритроцитів, моноцитів/макрофагів, мегакаріоцитів. На ній експресуються макромолекули, специфічні для мієлоїдних клітин — С033.
Індукція диференціювання всіх юіітин-попередниць відбувається під впливом ростових факторів (колонієстимулюючі фактори
(КСФ) та інтерлейкіяи ІЛ), котрі специфічні для кожного паростка. Більшість КСФ та ІЛ продукуються стромальними та гемопо-етичними кіітинами (фібробласти, ендотеліальні, епітеліачьні клітини, Т-лімфоцити. моноцити, макрофаги). Винятком є еритропоетин та тромбопоетин. котрі екскретуються клітинами нирки та являють собою глікопротеіни з низькою молекулярною масою. Ростові фактори впливають на клітини-попередниці через спеціальні мембранні рецептори, зумовлюючи їх активацію і проліферацію.
Вирізняються ростові фактори, що активують родопочаткові клітини, — ранодіючі фактори і ростові фактори, котрі реагують із більш диференційованими кіітинами — пізнодіючі фактори. До ранодіючих факторів відносять стовбурово-клітинний фактор Сті-ла (SCF), ІЛ-1, ІЛ-З, ІЛ-6 та туморнекротичний фактор (TNF). ІЛ-1 та TNF індукують вироблення факторів росту гранулоцитів (Г-КСФ), гранулоцитів-макрофагів (ГМ-КСФ), еозинофілів (ІЛ-5), B-клітин (ІЛ-6), Т-клітин (ІЛ-4 та ІЛ-2), а також беруть участь у інших регуляторних механізмах. Встановлено, що ІЛ-1 не лише здатен стимулювати клітини гемопоезу, а й підсилює активність власних стромальних клітин. Туморнекротичний фактор різнобічно впливає на гемопоетичні клітини, індукуючи гранулоцито-поез та пригнічуючи ранні попередники, а також попередники еритропоезу та лімфоцитів. Особливістю ранніх цитокінів є їх дуже висока біологічна активність, взаємодія з клітинами різних паростків на різних етапах диференціювання та висока кооперація з іншими факторами росту.
Для кожного гемопоетичного паростка існує складна система регуляції пізнодіючими факторами. Всі етапи диференціювання клітин гранулоцитарного, еритроїдного і мегакаріопитарного паростків представлені у кістковому мозку морфологічно ідентифікованими формами. У кожному паростку найбільш раннім елементом є бласт. Загалом вони становлять 0,5-3% клітин кісткового мозку.
Гранулоцитарний паросток скидається з трьох типів клітин — нейтрофіли, еозинофіли та базофіли.
Мієлобласти — це ранні форми: гранулоцитів, які становлять 0,5-2% мієлокаріоцитів. Морфологічно це клітини середнього діаметра (10-15 мкм) з колоподібним ядром, дисперсною структурою хроматину та 2-3 нуклеолами. Цитоплазма їхня забарвлюється У світло-блакитний колір. При цитохімічному дослідженні у міє-
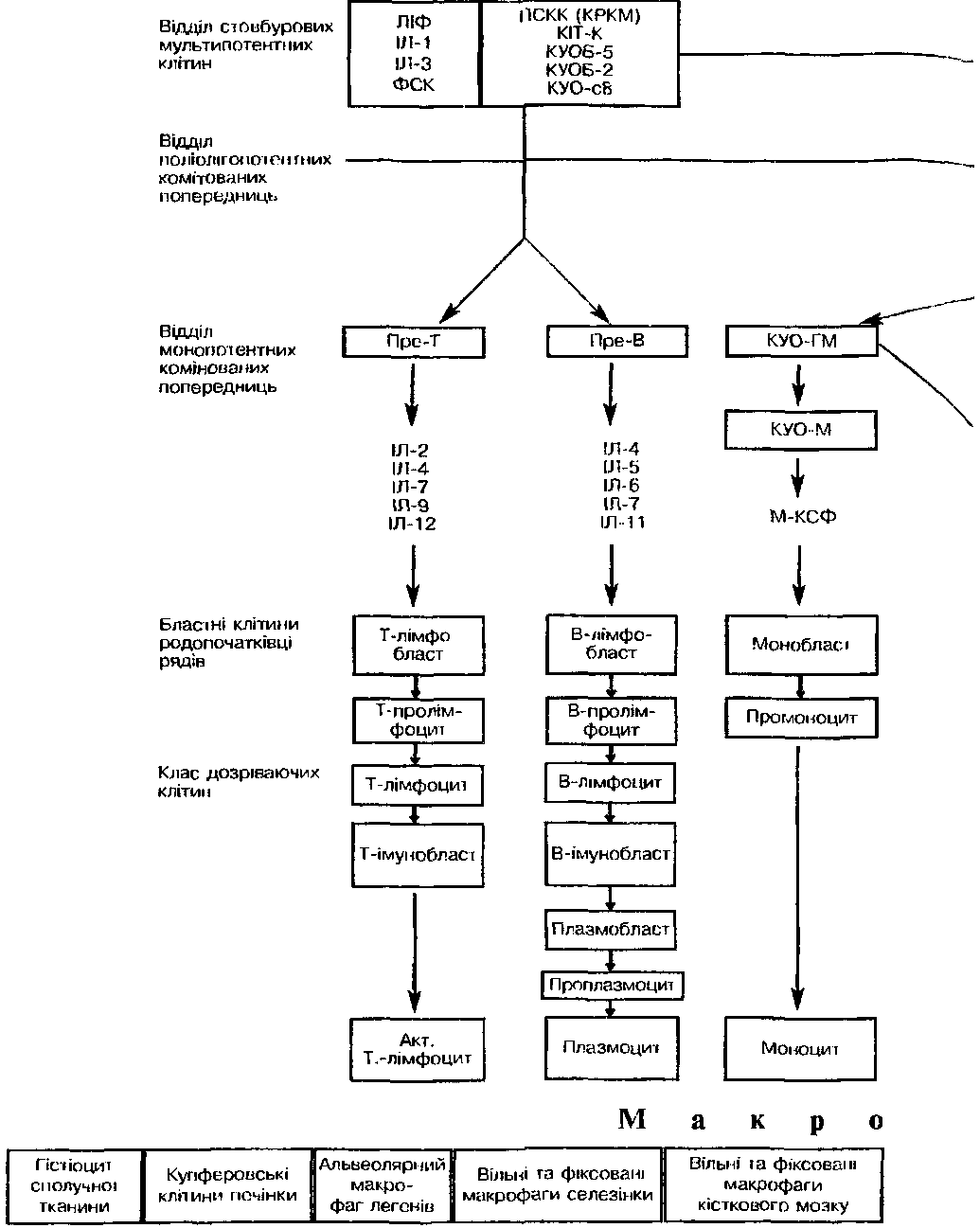
Рисунок 1. Схема кровотворення
лобластах нейтрофільного й еозинофільного рядів визначається пе-роксидаза, ліпіди у реакції із Суданом чорним В та ШИК-позитив-на речовина, розташована в цитоплазмі дифузно. Наявність перок-сидази та ліпідів є характерною цитохімічною ознакою клітин гранулоцитарного ряду, що зберігається в них у період повної зрілості — сегментоядерних форм.
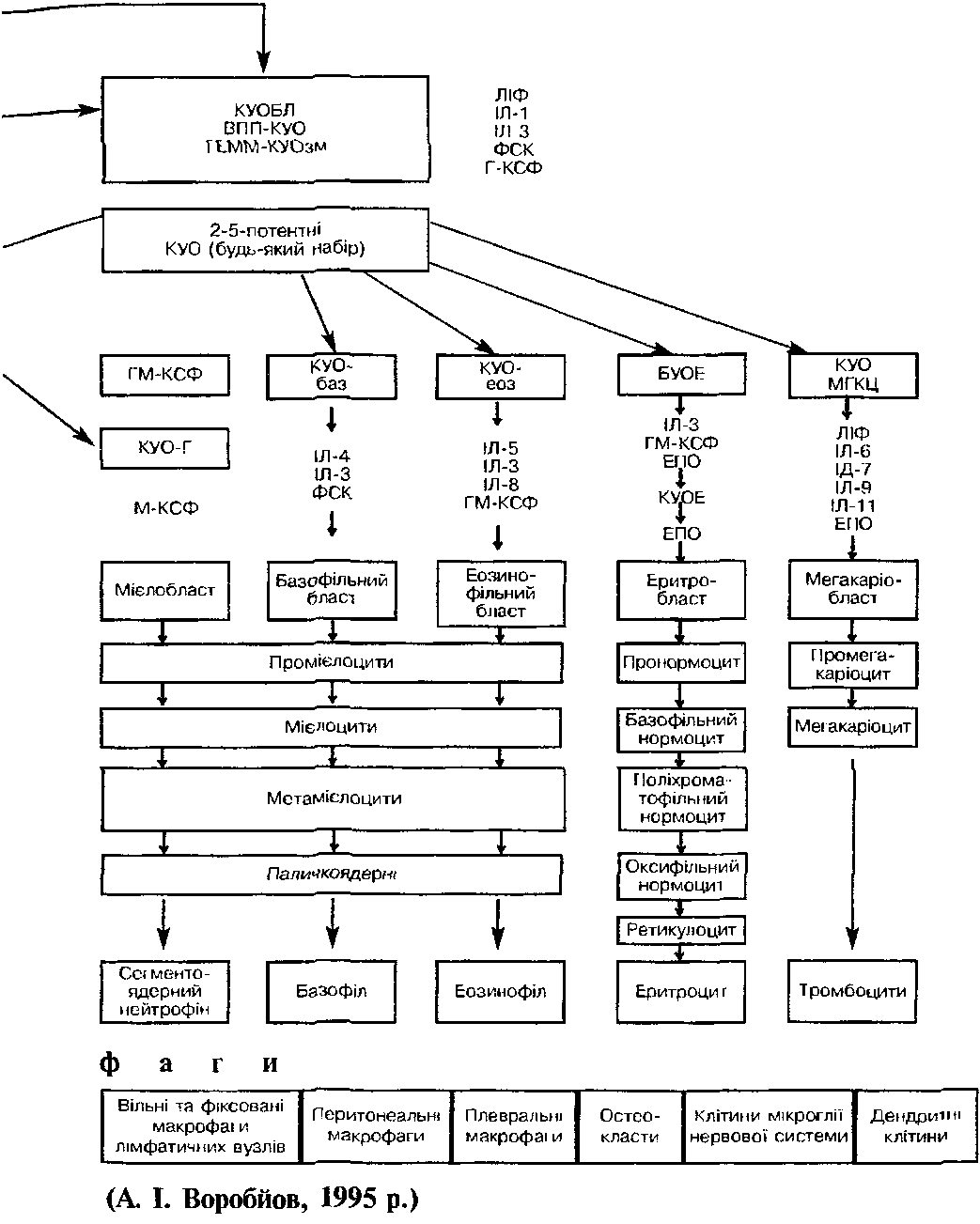
Фенотип мієлобластів характеризується наявністю антигенів, котрі виявляються з допомогою МКА Сиіг СО,, (рис. 2). Тривалість життя мієлобластів становить 18 годин, за цей час вони можуть здійснити 1-2 мітози.
Промієлоцити нейтрофільного ряду становлять 2-4% мієлока-ріоцитів. Це великі клітини діаметром 13-18 мкм. Ядра в них розташовуються ексцентрично й містять тонкодисперсний хроматин та 1-2 великі нуклеоли. Цитоплазма широка, слабко базофільна, у ній синтезуються первинні лізосомальні гранули, що забарвлюються азуром. У первинних гранулах міститься велика кількість ферменту пероксидази та ліпідів, котрі є маркерами нейтрофілів.
Фенотипично характеризується антигенами СБВ. СГ333, СБ34, НІА-БК
Мієлоцити нейтрофільні становлять 13% мієлокаріоцитів, діаметр клітини — від 10 до 15 мкм, тривалість життя — до 104 год., за цей час вони спроможні зробити 3-4 мітотичні цикли. Це остання стадія розвитку нейтрофілу, на котрій клітина здатна до ділення. Мієлоцит містить ядро з дещо грубою структурою хроматину та поодинокими дрібними нуклеолами. У цитоплазмі поряд із первинними з'являються численні вторинні гранули. Наявність їх є специфічною ознакою нейтрофільних мієлоцитів. У цих гранулах містяться глікопротеіни (лактоферин, білок, зв'язуючий вітамін В12, НАДФ-Н-оксидазу, цитохроми).
Метамієлоцити, паличкоядерні та сегментоядерні нейтрофіли являють собою пул клітин, не здатних до ділення. Дозрівання їх у кістковому мозку триває 96-144 год. За цей час ядро набуває сег-ментованої форми, збільшується ядерно-цитоплазматичне відношення. Зрілі гранулоцити затримуються у кістковому мозку 3-4 дні, вони складають "кістковомозковий фанулоцитарний резерв", їхня кількість у 2-3 рази перевищує кількість молодих гранулоцитів і майже у 10-30 разів — кількість циркулюючих нейтрофілів. У судинному руслі є два пули клітин — постійний (маргінальний, капілярний) та пул циркулюючих гранулоцитів. У нормальних умовах відбувається постійний обмін між обома пулами. У фізіоло-
Рисунок 2. Поверхневі антигени клітини гемопоезу гічних умовах нейтрофіли, що потрапили в тканини, не повертаються у судинне русло: вони депонуються в капілярній сітці легенів та меншою мірою в паренхімі печінки та селезінки.
За потреби спостерігається посилений вихід гранулоцитів у тканини. Вони здатні рухатися в напрямку вогнища інфекції, поглинати та перетравлювати бактеріальні мікроорганізми з допомогою складного процесу фагоцитозу.
Еозинофіли в процесі дозрівання під впливом еозинофільного диференціювального фактору, котрий є лімфокіном і продукується Т-клітинами, проходять стадію промієлоцита, мієлоцита, мета-мієлоцита, паличкоядерної та сегментоядерної форм. Дозрівання еозинофілів у кістковому мозку триває 2-6 днів.
На мембрані зрілих еозинофілів визначаються рецептори до І^С, І£р, ІіЕ, СзЬ-компонента компліменту та рецептори, що беруть участь у реакціях на різні хемотаксичні стимули у вогнищах запалення.
Фізіологічна активність еозинофілів, як і інших кістковомозко-вих клітин, залежить від впливу регуляторних цитокінів, таких як ГМ-КСФ, ІЛ-5, ІЛ-3. Специфічним та найефективнішим для утворення еозинофільних колоній є ІЛ-5.
Еозинофілам властива імунозахисна функція проти гельмінтів, бактерій, вірусів, грибів і, можливо, проти злоякісних пухлин. Вони є модуляторами реакції гіперчутливості. Еозинофіли беруть участь у регуляції системи згортання, активуючи фактор XII (Хаге-мана) та плазминоген.
Базофіли, що містяться у кістковому мозку та периферичній крові, й тучні клітини у тканинах становлять загальну популяцію гістамшвмісних елементів.
Базофільного бласту в кістковому мозку не виявлено. Базо-фільний промієлоцит спостерігається дуже рідко.
Тучні клітини в нормі в периферичній крові не виявляються. Зустрічаються поодинокі клітини в кістковому мозку. Зазвичай тучні клітини містяться у сполучній тканині біля епітеліальних клітин, в оточенні кровоносних судин, у серозних порожнинах. Стимуляторами базофілів є ІЛ-1, ІЛ-3 та колонієстимулюючий фактор базофілів ГМ-Баз-КСФ.
У базофілів на відміну від еозинофілів та нейтрофілів відсутня здатність до фагоцитозу.
Базофіли й тучні клітини секретують гістамін, кінін, специфічні естерази, трипсин, хемотрипсин.
На поверховій мембрані базофілів експресується рецептор до ІіЕ, сполучення з котрим призводить до анафілактичної деграну-ляції клітин. Таку ж реакцію можуть провокувати й деякі лікарські препарати, гормони, тривале переохолодження. Під час цієї реакції із гранул вивільнюються такі біологічно активні речовини, як гістамін та мегаболінін арахідонової кислоти. Гістамін бере участь у негайній відповіді гіперчутливості та є потужним хе-моатрактантом еозинофілів, фіксуючи їх у місці дегрануляції базофілів при астмі, уртикаріях, алергічних ринітах та анафілаксії. Водночас у еозинофілах міститься речовина, що інактивує вміст гранул базофілів.
Базофіли разом із еозинофілами є медіаторами позаклітинного запалення. При співдії з такими чинниками імунної системи, як моноцити, макрофаги, лімфоцити, вони беруть участь у нормальній імунологічній відповіді на інфекцію, пухлину або паразитарну інвазію.
Моноцити. Перша морфологічно розрізнювана клітина моно-цитарного ряду в кістковому мозку — монобласт. Проходячи два мітотичних цикли, він через фазу промоноцита утворює чотири моноцити.
Зрілі моноцити кісткового мозку та периферичної крові являють собою великі — діаметром 15-20 мкм — клітини, що мають поліморфне ядро частіше лопасної, бобоподібної або підковоподібної форми. Цитоплазма їх забарвлюється у сіро-блакитний колір та містить незначну пилоподібну зернистість.
У клітинах моноцитарно-макрофагального ряду на всіх етапах диференціювання виявляється неспецифічна естераза, що пригнічується фторидом натрію, кисла фосфатаза, що пригнічується тар-тратом, ШИК-позитивна речовина в дифузній формі. У моноцитах міститься невелика кількість пероксидази та ліпідів. Неспецифічна естераза є цитохімічним маркером моноцитів.
У нормі не всі попередники моноцитів проліферують до зрілих форм. У кістковому мозку зберігається резерв, котрий використовується організмом у разі виникнення запалень. У такому випадку молоді моноцити із кісткового мозку потрапляють у периферичну кров, де циркулюють від 36 до 104 годин, водночас формуючи пристінчастий та циркулюючий пули.
В нормі основна частина життя моноцитів проходить у тканинах, суттєво видозмінюючись морфологічно. Клітина збільшується та набуває неправильної форми, в кістках утворюються поліплоїдні багатоядерні форми, котрі називаються остеокластами. Перебуваючи у тканинах, макрофаги утворюють дві великі підгрупи клітин — альвеолярні макрофаги, клітини Купфера, остеокласти, популяцію фагоцитуючих форм та антигенпрезентуючих форм.
Фагоцитуючі клітини здатні до хемотаксису, фагоцитозу та бактерицидної активності. Ці властивості реалізуються з допомогою Ис- або СзЬ-рецепторів та мембрани клітини протеазами, що знаходяться в гранулах, та системою окислювачів (перекис водню, йодиди, броміди калію та натрію). Макрофаги можуть фагоцитува-ти більшість мікобактерій, вірусів, грибів та найпростіших, але порівняно з нейтрофілами їхня антимікробна функція значно слабша. Макрофага поглинають та перетравлюють ушкоджені та віджилі клітини. Макрофаги селезінки секвеструють дефектні та застарілі еритроцити, повертаючи залізо до еритроцитарного пула. Макрофаги легенів спроможні захоплювати сторонні частки, навіть азбест.
До антигенпрезентуючих форм макрофагів належать клітини Лангерганса шкіри, інтердигітуючі клітини підгрудинної залози та фолікулярні дендритичні клітини зародкових центрів лімфатичних вузлів, котрі не здатні до фагоцитозу. Функція цих макрофагів полягає в презентації антигенів Т-хелперам, котрі, в свою чергу, взаємодіють із В-лімфоцитами, стимулюючи їх до продукції імуногло-булшів.
Моноцитарно-макрофагальна система відіїрає важливу роль у імунологічному протипухлинному захисті організму при онкопро-цесах. Не менш важливою є здатність моноцитарно-макрофагаль-них клітин синтезувати та секретувати біологічно активні речовини, які відносять до розряду цитокінів. До цих білків і пептидш належать інтерферони, інтерлейкіни, лізоцим, туморнекротичний фактор, фактор активації нейтрофілів, колонієстимулюючі — гра-нулоцитарний та фанулоцитарно-макрофагальнгш фактори, ростовий трансформуючий фактор, макрофагальні загальні білки.
Клітини моноцитарно-макрофагального ряду продукують також такі гідролітичні фактори, як протеази (плазміноген, коллаге-наза, еластаза), фактори згортання крові V, VII, IX, X та протромбін. Багато з цих факторів, комплексно взаємодіючи, беруть участь у регуляції росту гемопоетичних клітин, у гострій фазі запалення, метаболічних процесах печінки, в механізмі розвитку кахексії та анемій, пов'язаних із хронічним запальним процесом, здійснюють продукцію простагландинів.
Еритробласти кісткового мозку мають вигляд великих клітин правильної форми з округлим ядром, розташованим у центрі. Хроматин ядра має ніжносітчасту структуру, виявляється одна велика нуклеола. Цитоплазма інтенсивно базофільна. Еритробласт експре-сує антиген СО% та глікофарин А (рис. 2).
Здійснивши 4-5 мітозів, еритробласт переходить у категорію нормобластів. При дозріванні забарвлення цитоплазми із базофіль-ного поступово змінюється на поліхроматофільне, а потім на окси-фільне внаслідок накопичення в ній специфічного білка (гемоглобін). У поліхроматофільній стадії у нормобласту зникає мітотична активність. В період оксифільної стадії нормобласт втрачає ядро і переходить до категорії ретикулоцитів.
Ретикулоцит набуває вигляду двоввігнутого диска діаметром 8-9 мкм та протягом 1-2 діб дозріває у кістковому мозку. В цей час, втрачаючи рецептори до трансферину та зменшуючись, цитоплазма його стає еластичною. Набувши нових якостей, ретикулоцит із кісткового мозку переходить у периферичну кров і, потрапляючи в селезінку, остаточно дозріває, переходячи в категорію еритроцита.
Специфічною цитохімічною реакцією для нормобластів та еритроцитів є реакція на сідерофільні гранули. Збільшення вмісту цих гранул у клітинах свідчить про неефективний еритропоез у кістковому мозку, зменшення гранул в еритроцитах — ознака дефіциту заліза в організмі.
Регуляція еритропоезу відбувається під впливом цитокінів. Найвідомішим із них є еритропоетин, котрий продукується в основному7 нирками і незначною мірою — клітинами моноцитарно-макрофагального паростка.
Тривалість життя еритроцитів — 120 діб. Щодня продукується в кістковому мозку та руйнується в системі циркуляції та селезінці 2 • 10і 1 клітин. Еритроцити не мають кістковомозкового резерву, деяка частина їх депонується в судинах шкіри та селезінки.
Мегакаріоцити розвиваються із недиференційованої стовбурової клітини і становлять надзвичайно мату частку серед ядровміс-них клітин кісткового мозку. Весь життєвий цикл мегакаріоцитів проходить у кістковому мозку.
Попередниками мегакаріоцитів у кістковому мозку, що морфологічно ідентифікуються, є мегакаріобласти. На поверхневій мембрані мегакаріобластів експресуються антигени СОьг
Зрілі мегакаріоцити — найбільші кістковомозкові клітини в кістковому мозку, до 40-50 мкм. Одна юіітина містить 32-64 ядра та пишну цитоплазму рожевого колюру, де формуються тромбоцити.
Імунологічний фенотип клітин мегакаріоцитарного паростка визначається експресією антигенів до пластинчатих факторів тромбоцитів 4 та 8 (Р4 та 8), глікопротеїнів (GP) II. 16 і Ilia (CD41. CD42, CD42b, CDw49 та CD61) (рис. 2).
Регуляція мегакаріоцитопоезу відбувається за участі цитокінів ІЛ-3. ГМ-КСФ та Мег-КСФ, що стимулюють його ранні етапи та продукуються клітинами стромального оточення, нирок, лімфоцитами й моноцитами. Тромбопоетин, ІЛ-6, мегакаріоцитарний стимулюючий фактор індукують диференціювання переважно зрілих мегакаріоцитів, проте не виключений їх вплив на ранні форми.
До інгібіторів тромбоцитопоезу належать трансформуючий ростовий фактор, тромбоцитарний ростовий фактор IV. Обидва ці цитокіни посилюють мітотичну активність фібробластів, а трансформуючий ростовий фактор стимулює синтез колагену в кістковому мозку.
Кількість тромбоцитів у периферичній крові в нормі коливається від 150 до 400 • 109/л; такі широкі межі свідчать, що їхня кількість регулюється не жорстко. Тромбоцити різні за розміром, віком, щільністю та функціональною активністю. Об'єм (MCV) тромбоцитів обернено пропорційний їхній кількості, тому в людини загальний об'єм тромбоцитної маси є постійною величиною Тривалість життя тромбоцитів — 10 діб. Щодня тромбоцитів продукується до 40 • l(f/n.
Лімфоїдний паросток гемопоезу складається із В-, Т- та NK-клітинних ліній. Клітина-попередник має морфологічну характеристику бластів. Ідентифікація лінійної належності та етапів диференціювання лімфоїдних елементів можлива лише за умови імунофенотипового дослідження.
В-лімфоїдні попередники в кістковому мозку — центральному органі В-лімфопоезу — проходять антигеннезалежну стадію дозрівання. На найбільш ранніх про-В-клітинах зберігаються антигени стовбурових елементів (CD34 та CD38) і з'являються специфічні макромолекули naH-B-CDw, а потім цитоплазматігчний CD22. Ці антигени характерні для всіх клітин В-лімфоїдного ряду. Згодом на пре-пре-В-клітинах зменшується кількість стовбурово-клітинних та з'являються інші В-ацтигени — CD10, CD20 та CD24. На стадії пре-В-бластів у цитоплазмі клітин з'являються ланцюги Ig. На останньому етапі В-диферегщіювання на мембрані лімфо-
їдних клітин експресується повна молекула (легкі та великі ланцюги) І£М.
Морфологічно зрілі, але імунологічно "наївні" В-лімфоцити потрапляють у кров та в периферичні органи імунітету — лімфатичні вузли та селезінку. Після проходження в зародкових центрах вторинних лімфощних фолікулів антигензалежної стадії диференціювання формується пул зрілих В-лімфоцитів та плазматичних клітин, здатних синтезувати та продукувати імуноілобуліни різних класів та брати участь у гуморальній відповіді імунної системи.
Попередники Т-клітин у кістковому мозку експресують стовбурово-клітинні (СС,4, НІЛ-От) та (С07, цитоплазматичний СГ>з±) Т-антигени. Вийшовши із кісткового мозку, Т-попередни-ки мігрують у тимус — центральний орган Т-лімфопоезу, після чого надходять у периферичні лімфоциті органи, де відбувається ан-тигензалежна стадія диференціювання. У підгрудіїнній залозі здійснюється перебудова генів, котрі кодують Т-клітинний рецептор — і він з'являється на поверхневій мембрані.
У період дозрівання в тимусі на лімфоїдних елементах дещо змінюється комплекс мембранних антигенів. На ранніх тимоцитах експресуються макромолекули Тітуї, С05 та цитоплазматичний СОг Антиген С03 є імуноспецифічною ознакою всіх Т-клітин. На кортикальних тимоцитах визначаються антигени СОг СЦ, та СВ8. На останньому етапі медулярні тимоцити розділяються на дві фракції клітин, що експресують С04 або СБ8 Зрілі Т-лімфоцити перебувають у периферичній крові, в тимусзалежних ділянках селезінки, лімфатичних вузлів, мигдаликів, нейферових бляшок. У периферичній крові Т-лімфоцитарний пул існує у вигляді двох фракцій — хелпери/ефектори (СБ4+) та супресори/цитотоксичні клітини (СТ>8+). Т-лімфоцити CD4+ поділяються на два субтипи: Т-хелпери-1 і Т-хелпери-2. Т-хелпери-1 сприяють підсиленню синтезу та продукції В-клітинами І£; Т-хелпери-2 допомагають індукувати антигенспецифічну активність Т-супресорів.
Т-лшфоїдні клітини не синтезують і не секретують імуногло-буліни. Вони продукують цитокіни, котрі регулюють проліферацію та диференціювання інших клітин і беруть участь у клітинній імунній відповіді.
Природні (натуральні) кілери ^К-клітини) мають незалежну лінію диференціювання. У периферичній крові морфологічно вони визначаються як великі гранульовані лімфоцити, що мають ядро з невеликою виїмкою та великими азурофільними гранулами.
Вони експресують С03-, СБ,6+, СБ56+ антигени та мають на мембрані рецептор до СІ12 (СЗсГ), вірусу Епштейна—Барра, Рс-рецеп-тор — для ]£. Натуральні кілери можуть відповідати за спонтанну клітинну цитотоксичність (рис. 2).
⇐Кровотворення || Оглавление || Методи обстеження гематологічних хворих⇒